Comment calculer le rendement de purification ?

Plan de l'article
- Cours Physik chimie | première spécialité
- Journal d’un synthèse organique
- Qu’ est-ce qu’une synthèse organique ?
- qu’ est-ce qu’un Protocole ?
- Les étapes les plus importantes d’une synthèse
- fabrication de réactifs
- Paroi de réactif
- Chauffage à refoulement
- Isolation et nettoyage du produit de synthèse
- Analyse et caractérisation des
- performance d’un Synthèse
- Combien coûte le rendement d’un Synthèse ?
- Évaluation et unité
- Calculer le chiffre d’affaires d’un résumé
- Valeur d’un retour
- Calculer un retour Dimensions du produit
- Calculez le rendement de
- Comment expliquez-vous cette performance d’une synthèse est faible ?
- Pour réviser
- Autres premiers cours spéciaux
- Approfondir et découvrir
Cours Physik chimie | première spécialité
Ce cours est conforme à la section « Synthèses des espèces chimiques organiques » du premier programme spécial.
Il fait partie du programme « Constitution et transformations de la matière — propriétés physico-chimiques, synthèses et brûlures d’espèces chimiques organiques »
A lire également : Est-il possible d'avoir un prêt immobilier sur 30 ans ou plus ?
Protocole de synthèse organique
- Qu’ est-ce qu’une synthèse organique ?
- Qu’ est-ce qu’un protocole ?
- Les principales étapes de la production de synthèse organique
- de réactifs réactifs
- conversion reflux
- chauffage
- isolation et purification du produit à partir de l’analyse de synthèse
- et la caractérisation du produit
Retour d’un résumé
A voir aussi : Les nouveautés déco qui feront sensation dans votre intérieur
- Quel est le rendement d’une synthèse ?
- Évaluation et unité
- Calculer le rendement d’une synthèse
- Valeur de rendement
- Calculer le rendement à partir des dimensions
- du produit Calculer le rendement à partir des quantités
- Comment expliquer que le rendement d’une synthèse est faible ?
de produits
REVISION — AUTRES PREMIERS COURS SPÉCIALISÉS — DEEPTH AND DISCOVER
Journal d’un synthèse organique
Qu’ est-ce qu’une synthèse organique ?
La synthèse chimique a déjà été discutée en deuxième place (voir deuxième cours sur les transformations chimiques).
Pour rappel, une synthèse équivaut à un certain nombre de processus impliquant au moins une transformation chimique pour produire une espèce chimique.
Une synthèse est appelée organique sileproduit chimique qu’elle veut produire est organique.
qu’ est-ce qu’un Protocole ?
Le protocoledécrit toutes les opérations nécessaires pour effectuer une Synthèse.
Il PRÉCISE :
- Les réactifs et leurs quantités
- verrerie (béchers, pipettes…) à utiliser en spécifiant la capacité des différents récipients
- Le matériel (accessoires, appareils…)
- Les conditions physiques dans lesquelles la (les) transformation (s) chimique (s) doit (s) se produire (température, pression…)
- Peut-être la durée des différentes opérations (chauffage, séchage…)
de
.
Les étapes les plus importantes d’une synthèse
biologique
Le Les principales étapes qui impliquent une synthèse sont Organique suivant :
- Production de réactifspesant ou mesurant le volume de chaque réactif.
- Transformations de réactifs Les réactifs sont présents dans des conditions qui favorisent la transformation chimique.
- Isolement et purification du produit de synthèse Les espèces chimiques synthétisées sont extraites du milieu de réaction en tentant d’éliminer les autres espèces chimiques présentes.
- Analyse et caractérisation des produits On tente de vérifier, par des essais physiques ou chimiques, si l’espèce chimique isolée est celle qui doit être obtenue.
fabrication de réactifs
La quantité prévue dans le protocole est utilisée pour chaque réactif impliqué dans la transformation chimique.
- Pour un réactif solide (souvent sous la forme de poudre) est effectué avec une pesée. Une échelle (d’une précision suffisante), un Une spatule et une chaussure de pesage (ou une tasse) sont utilisées.
- Avec un réactif liquide , nous mesurons le volume. Pour une précision maximale, la mesure du volume est effectuée à l’aide d’une pipette volumétrique ou d’une pipette graduée. Par conséquent, le matériau utilisé est une pipette (graduée ou graduée) et une propipette.
chez à partir de ce moment, il est également possible de préparer le solvant. Son volume n’a généralement pas besoin d’être mesuré avec précision maximum et peut être limité à la mesure avec une éprouvette diplômé.
Que se passe-t-il si le protocole ne spécifie pas les quantités de réactifs à utiliser ?
Dans ce cas, il est nécessaire de déterminer les quantités de réactif :
- En fonction, la quantité de produit que vous souhaitez synthétiser.
- Utiliser la table de progression pour déterminer la progression maximale et la quantité initiale de chaque réactif.
- Excédents possibles d’un réactif qui facilite l’extraction et la purification des espèces chimiques synthétisées.
Comment déterminer la masse d’un réactif à partir de sa quantité de matériau ?
Si le journal indique la quantité de matériau d’un réactif solide, mais pas sa masse, ce dernier peut être calculé grâce à la relation :
m = n x M
Où :
- n est la quantité de matière dans les moles (mol)
- M est la masse molaire du réactif en grammes par mole (g.mo-1), il peut être facilement calculé à partir de la formule brute (voir la quantité de matériau du premier plat, le poids moléculaire et la concentration)
- m est la masse de réactif désirée
Comment déterminer le volume d’un liquide Réactifs de sa quantité de matière ?
Si le log indique la quantité de matière dans un réactif liquide au lieu d’indiquer son volume, alors le réactif liquide peut être calculé :
- Par la première détermination de sa masse « au moyen de la relation m = n x M (voir paragraphe précédent)
- , le volume de masse et de densité est calculé en utilisant le rapport ******** 0, où m est la masse en grammes (g), ρ est la densité en grammes par litre (G.L-1) et V est le volume du liquide recherché en litres (L)
Paroi de réactif
Pour que la transformation chimique ait lieu dans les meilleures conditions, il est nécessaire :
- Placer les réactifs dans un récipient approprié (souvent un ballon)
- Placer le milieu de réaction dans des conditions physiques optimales (chauffer pour augmenter la température)
- Favoriser le contact entre les réactifs (agitation)
- Limiter la perte de réactifs et de produits, en particulier pendant le chauffage (utilisation de l’eau ou de l’air inverse)
- instructions
Chauffage à refoulement
- Pourquoi ? chauffer le milieu de réaction ?
Certaines transformations chimiques, telles que les réactions de précipitation ou de combustion, sont rapides, mais la plupart des transformations impliquées dans la synthèse organique sont lentes : la consommation totale de réactifs (ou peut-être le réactif limitant) peut durer de plusieurs minutes à plusieurs heures.
Pour accélérer ces transformations chimiques (augmenter la soi-disant « vitesse de réaction ») Le mélange de réaction peut être chauffé, car les transformations chimiques dans la plupart des cas sont d’autant plus rapides, car la température est élevée.
chaleur le milieu de réaction aide à accélérer la réaction de synthèse.
- Le Inconvénients d’un simple réchauffement
Le chauffage du mélange réactionnel favorise l’évaporation des espèces chimiques : certains réactifs, produits et solvants peuvent être libérés dans l’air sous forme gazeuse.
UN Par conséquent, le chauffage simple risque de perte de matériel :
- lequel quantité de produit synthétisé sera plus faible
lequel les vapeurs libérées peuvent poser un risque pour la santé
- Le Principe de chauffage à contre-courant
L’ exemption des vapeurs ne peut pas être évitée simplement en chauffant un récipient fermé : la pression dans celui-ci augmenterait avec la température et il y a un risque d’explosion.
Au cours de la Réchauffement par reflux, le milieu de réaction est toujours exposé à la même pression (pression atmosphérique), mais les vapeurs du milieu de réaction chauffé augmentent dans un réfrigérant refroidi qui provoque sa liquéfaction. Les gouttes liquides qui se forment sur les parois du réfrigérant finissent par retomber dans le milieu de réaction : il y a reflux !
Le chauffage par reflux est un système de chauffage avec un réfrigérant dans lequel les vapeurs du réactif , du produit et du solvant ne sont plus déchargées dans l’air, mais sont liquéfiées et réintègrent le milieu de réaction.
Le réchauffeur de recul lui-même Le plus souvent fait avec un réfrigérant Eau, mais parfois même peu fait avec un liquide de refroidissement à air.
- chauffage Rétro-débit avec liquide de refroidissement à eau
Le L’assemblage comprend les éléments suivants :
Le Tige : permet à la balle de s’accrocher de manière stable et frigorigène.
Le ballon : Les réactifs sont fusionnés, il permet de chauffer le milieu de réaction plus uniformément qu’un récipient à fond plat (comme un Erlenmeyer).
Le Chauffage par ballon : c’est le système de chauffage qui convient au ballon.
Le Montage élévateur (également appelé standboy) : Il prend en charge le Le chauffage des ballons, qui, d’une part, permet d’augmenter sa hauteur contact optimal à la balle et, d’autre part, il peut être abaissé pour enlever ce contact et empêcher le chauffage Ballon dans une valise d’urgence.
Le liquide de refroidissement à eau : il est fixé à l’arbre par des pinces et ajusté au ballon. Il a un « canal intérieur » qui communique le ballon avec l’air pour maintenir une pression proche de la pression atmosphérique. Ses murs sont creux et sont traversés par un flux d’eau froide obtenu en reliant l’entrée d’eau (en bas) à un robinet qui alimente l’eau froide, tout en drainant l’eau à travers la sortie d’eau (en haut) et versé dans un évier.
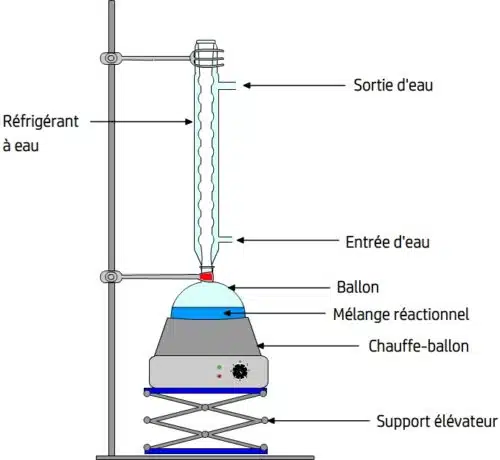
Chauffage par reflux avec liquide de refroidissement à eau
- chauffage Rétro-flux avec refroidissement par air
Il est implémenter un périphérique plus simple et besoin de moins de matériau comme un chauffage par reflux avec du liquide de refroidissement à eau.
Il peut être utilisé dans le cas où la synthèse a lieu avec un chauffage modéré (par exemple, dans le bain Marianske), ce qui n’est pas nécessaire pour l’ébullition et avec des espèces chimiques faiblement volatiles (dont la température d’ébullition est significativement plus élevée que celle dans laquelle le mélange de réaction est chauffé).
Dans dans ce cas, le liquide de refroidissement est simplement l’air ambiant.
Le qui est le conteneur Le milieu de réaction contient (souvent un Erlenmeyer) est fermé par un bouchon sur un trou où un tuyau est fixé verre (qui en général est simplement une pipette en verre).
Ce tube de verre est refroidi par l’air ambiant et permet la liquéfaction des vapeurs qui pourraient émerger du milieu de réaction.
Isolation et nettoyage du produit de synthèse
Lorsqu’ une espèce chimique est synthétisée, elle est mélangée avec les autres types du système chimique : réactifs inutilisés, solvants, autres produits…
Il est donc nécessaire de l’extraire (isoler) et d’enlever toutes les traces d’autres espèces chimiques (nettoyer)
Les techniques utilisées pour isoler et purifier ce type dépendent de leur condition physique, de leurs propriétés chimiques et des caractéristiques des espèces chimiques dont ils sont séparés doit.
- Le Filtration :
eux peut être utilisé pour isoler un produit solide, Milieu de réaction qui se produit sous la forme de particules solide.
Voir la fiche de formation Filtration
- Extraction liquide liquide (également connu sous le nom d’extraction par solvant) :
eux peut être utilisé sur un produit solide qui est inclus dans le Milieu de réaction.
Voir la fiche de classe d’extraction de solvants
- La poire décantation :
Il peut être utilisé pour séparer une espèce organique non liquide miscible avec l’autre phase du milieu de réaction.
- Le Distillation :
Il peut être utilisé pour isoler une espèce chimique liquide miscible à condition que l’écart entre sa température d’ébullition et celle des autres espèces chimiques du mélange est suffisant (au moins environ 10 degrés).
Analyse et caractérisation des
produit Une fois le produit synthétisé isolé et purifié, il est nécessaire de vérifier qu’il correspond aux espèces chimiques qui devraient donner la synthèse.
Pour ceci est fait avec des tests et des méthodes d’analyse chimique ou physique, qui peut être, par exemple
,
- Le Chromatographie
La plupart des espèces chimiques peuvent être révélées à l’aide d’une lampe ultraviolette, il est donc possible d’identifier la chromatographie pour. Il est réalisé en comparant un échantillon des espèces chimiques produites avec un échantillon de l’espèce chimique pure. Voir la fiche de cours « Chromatographie »
- Le Mesure de la température de fusion avec une banque Kofler
Si le produit de la synthèse est un solide, il peut être déterminé par son température de fusion peut être identifiée. Cela peut être déterminé à partir d’un échantillon sec du produit synthétisé avec une banque Kofler. Voir feuille « Température de fusion »
performance d’un Synthèse
Combien coûte le rendement d’un Synthèse ?
Le rendement est beaucoup qui va augmenter l’efficacité d’un synthèse organique, il indique en fait la proportion du produit obtenu en termes de montant maximum qui serait théorique possible d’obtenir.
Évaluation et unité
Le Le rendement est le plus souvent déterminé par la lettre grecque η ( eta)mais parfois d’autres notations sont utilisées (r, ρ..)
Le Le rendement n’est pas l’unité (car il est défini comme le rapport de deux ensembles de la même unité).
Calculer le chiffre d’affaires d’un résumé
Le rendement est le rapport entre les espèces chimiques synthétisées réelles produites (souvent appelées Nexp) par la quantité d’espèces chimiques qui auraient théoriquement dû être obtenues dans des conditions idéales (souvent nmax ou ntheo)
Elle peut donc être exprimée par la relation suivante :
Où :
- Nexp est la quantité de matière de l’espèce chimique synthétisée basée sur la mesure expérimentale du volume ou de la masse du produit synthétique après l’isolement et la purification. Il est exprimé en moles (mol)
- nmax est la quantité maximale de matière qui est théoriquement obtenue. Il est calculé à partir du tableau de progression de la réponse en supposant que l’ensemble du réactif limitant est consommé selon la stoechiométrie de l’équation de réaction. Il s’exprime également en taupe (taupe)
Le Le rendement peut parfois aussi être exprimé sous la forme d’un pourcentage, dans ce cas, il suffit de multiplier par « 100″ la valeur obtenue à partir de la formule précédente.
sous le pourcentage de rendement est exprimé donc par la relation suivante :
Valeur d’un retour
par Définir la valeur d’un retour est comprise entre 0 (0%) et 1 (100%)
Un rendement de « 0 » signifie que la synthèse n’a pas produit les espèces chimiques qui devraient être produites.
Plusieurs Les hypothèses sont alors doit être considéré comme étant le problème :
- Les conditions de transformation chimique peuvent ne pas être remplies.
- Un des réactifs a été oublié.
- L’ un des réactifs était remplacé à tort par une autre espèce chimique (par exemple, le bécher à base d’éthanol peut avoir été confondu avec celui contenant de l’eau distillée…)
- Une des techniques d’extraction ou de purification peut ne pas être adaptée et éliminée les espèces que nous voulions isoler.
Un rendement de « 1 » signifie que l’ensemble du réactif limitant a été converti en produit.
NOUS pourrait être impatient d’atteindre ce résultat, mais dans la pratique, Le rendement n’est jamais à son apogée, les diverses opérations qui Une partie d’un protocole de synthèse conduit inévitablement à pertes physiques et revenus plus ou moins toujours moins de 1.
Le rendement ne doit pas être supérieur à 1 dans tous les cas, un tel résultat est de l’une ou l’autre à :
- une erreur de calcul
- est une erreur de mesure
- isolation incorrecte du produit (il reste avec le solvant, d’autres produits mélangés ou réactifs inutilisés)
Calculer un retour Dimensions du produit
La masse d’une espèce chimique particulière est proportionnelle à sa quantité de matière :
m = n x M
Ainsi, la masse est obtenue en multipliant la quantité de matériau d’une espèce chimique par son poids moléculaire « M »
Par conséquent, le rapport de la masse du produit synthétique est mesuré (mexp) et la masse maximale calculée (mmax) est égale à :
Le rendement peut donc également être exprimé sous la forme d’un rapport de masses :
à Condition que les deux masses soient exprimées avec la même unité (les deux en grammes ou les deux en milligrammes…)
Calculez le rendement de
La masse d’une espèce chimique peut être déterminée par sa densité « ρ » comme produit de son volume « V » à exprimer :
m = ρ x V
En outre, le rendement de synthèse peut être exprimé par la relation suivante
Cette expression devient :
Dans le cas où l’espèce chimique synthétisée est liquide, le rendement de la réaction de synthèse peut être lié à :
Où :
- Vexp est le volume du produit obtenu par synthèse (mesuré)
Vmax est le volume maximal ce qui devrait être obtenu (calculé)
Le deux volumes sont exprimés dans la même unité (les deux en Litres ou les deux en millilitres…)
Comment expliquez-vous cette performance d’une synthèse est faible ?
Voici une petite liste d’explications Il est possible d’obtenir un faible rendement :
- Les réactifs collectés peuvent être des réactifs, en raison de leur désintégration pendant l’entreposage ont des quantités de matières inférieures à ce qui était prévu. (Les espèces réductrices peuvent être oxydées par l’oxygène atmosphérique, par exemple)
- Si l’eau distillée n’est pas pure, elle peut contenir des gaz qui peuvent consommer une partie des réactifs (le dioxyde de carbone peut réagir avec elle
- Espèces chimiques de base, le dioxygène peut oxyder certaines espèces chimiquement réductrices…) Une
- perte de réactifs peut survenir lorsqu’ils sont transférés dans le milieu de réaction (quelques gouttes peuvent se trouver dans les pipettes utilisées pour la collecte ou dans les gobelets utilisés pour le stockage temporaire)
- Si l’étape de chauffage n’est pas assez longue, le La réaction de synthèse doit être interrompue avant que la progression de la réaction ne soit maximale et que certains des réactifs ne soient pas transformés.
- Certaines réactions, bien sûr, sont « limitées » et ne permettent pas de consommer tous les réactifs (ou réactif limitant), elles conduisent à un état d’équilibre entre les réactifs et les produits qui persistent indépendamment de l’intensité et la durée du chauffage (par exemple
- réactions de synthèse d’esther de carboxylique acide et alcool). Ils consomment une partie des réactifs pour produire des espèces chimiques autres que celles prévues dans le protocole de synthèse.
- Les étapes d’extraction et de purification sont susceptibles d’entraîner une perte de produit si elles ne sont pas effectuées correctement (à l’aide d’un filtre défectueux, choix incorrect de solvant pour l’extraction liquide-liquide, distillat s’accumule trop tard pendant la distillation…
.
perte de réactifs ou de produits pendant l’étape de chauffage. Le chauffage par reflux limite ce risque, mais ne le supprime pas complètement (en particulier pour les espèces chimiques dont la température d’ébullition est proche de celle du solvant).
, les
Pour réviser
deuxième Cours :
- Corps pur et pur Mélanges quotidiens
- Types chimiques
- Mélanges
- corporels purs
- homogènes et hétérogènes
- Essai d’identification chimique
- Chromatographie
- Température d’ébullition d’une espèce chimique Température de fusion
- d’un espèces chimiques
- Solutions aqueuses
- solutions aqueuses et de leur préparation
- Transformation chimique
- Réactifs d’une transformation chimique
- Produits d’une transformation chimique
- Écrire et équilibrer une équation de réaction
- stoechiométrie
de types chimiques Mélanges
denses, exemple de mélange de
Autres premiers cours spéciaux
- Quantité de matière, masse molaire et concentration
- réaction redox et progression
- titrage redox Diagramme Lewis
- , géométrie, électronégativité
- polarisation Cohésion solide, dissolution, solubilité, hydrophilicité et lipophilicité
- Structure et nomenclature des espèces organiques
et
Approfondir et découvrir
- Dossier « Synthèse organique, chimie au service de l’homme » — Site Médiachimie
- Phases d’une synthèse organique — Vidéo du site ScholaWebTV su CRDPDdeversailles






